
14 décembre 2018
Bulletin interne de l'Institut Pasteur


Expliquer et partager les fondamentaux de la recherche clinique aux chercheurs : une mission du CRT
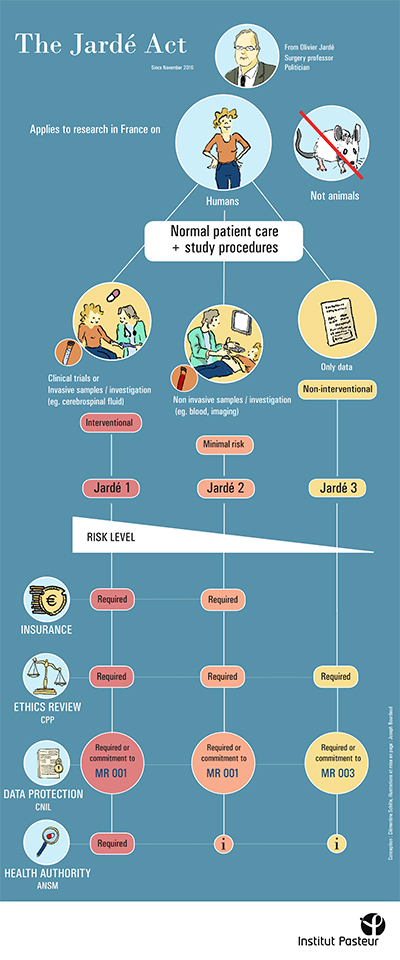
 À l’occasion de la publication de la 9e édition de l’enquête sur « l’attractivité de la France pour la recherche clinique » publiée par le LEEM, le centre de recherche translationnelle (CRT) souhaite rappeler les démarches obligatoires pour les recherches impliquant la personne humaine (échantillons, données cliniques ou essais cliniques).
À l’occasion de la publication de la 9e édition de l’enquête sur « l’attractivité de la France pour la recherche clinique » publiée par le LEEM, le centre de recherche translationnelle (CRT) souhaite rappeler les démarches obligatoires pour les recherches impliquant la personne humaine (échantillons, données cliniques ou essais cliniques).
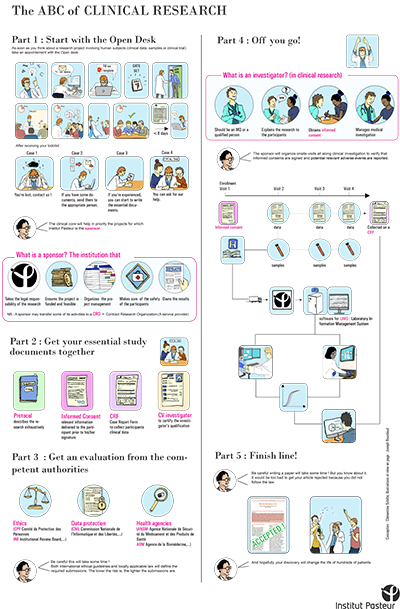
Pour cette mission et afin de rendre ses supports plus pédagogiques, le CRT s’est volontairement appuyé sur des illustrations, proposant ainsi un format original et simplifié. Pour ce faire, le CRT a fait appel à un stagiaire d’illustration scientifique de l’École Estienne, Joseph Bourdaud qui a réalisé les posters suivants :
Le poster « The ABC of clinical research », permettant de donner un premier aperçu simplifié de la recherche clinique impliquant la personne humaine à l’Institut Pasteur.Ce poster illustre en particulier l’importance de s’adresser très en amont à l’open desk du CRT
Le CRT en profite pour vous rappeler que, dès lors que votre projet implique des échantillons ou des données humaines, il est important de venir le présenter à l’Open Desk du CRT. Cet open desk a lieu tous les jeudis sur inscription et vous donne l’opportunité d’échanger avec l’ensemble des services supports qui vous seront nécessaires, et ainsi d’anticiper les démarches à réaliser (envoyer un mail à crt-opendesk@pasteur.fr)
- Essais cliniques : 9e enquête « Attractivité de la France pour la recherche clinique »
Cette enquête, réalisée à l’initiative du Leem, dresse un état des lieux de la recherche menée par les entreprises du médicament sur le sol français entre le 1er janvier 2016 et le 31 décembre 2017. Réalisée tous les deux ans depuis 2002, elle permet de suivre et d’évaluer la position de la France au sein de la compétition mondiale, d’en faire ressortir les points forts et les points faibles, afin de proposer des axes de progrès. Cette année, l’enquête du Leem s’enrichit d’une comparaison internationale, établie à partir de l’analyse de la base de données clinicaltrials.gov, qui complète l’enquête réalisée auprès des entreprises du médicament présentes en France.
Principaux résultats :
• Les industriels sont les principaux financeurs des essais cliniques
• La France est désormais au 4e rang européen pour les nouveaux essais cliniques industriels avec une participation qui est en baisse (-13% par an en moyenne)
• Sa participation aux nouveaux essais industriels mondiaux de phases 1 et 2 est limitée (6% et 13%, respectivement)
• Près de 7 mois sont nécessaires entre la 1ère demande d’autorisation et l’inclusion du 1er patient (6 mois avec la phase pilote du règlement EU)
• Au sein de plus de 3 300 centres ouverts, les investigateurs français respectent 85% de leurs objectifs de recrutement (100% en oncologie)
• L’oncologie est l’aire thérapeutique prédominante (participation à 19% des nouveaux essais industriels mondiaux et 45% des essais réalisés sur le territoire)